Na zaproszenie redakcji Nature Chemistry poznańscy naukowcy porównali nowo opracowaną metodę otrzymywania związków optycznie czynnych z dotychczas opisanymi w literaturze.
Wskazano zalety metody jak i pewne braki oraz określono potencjalne kierunki dalszych prac
The gains from breaking symmetry. J. Gajewy and M. Kwit, Nature Chem. 13, 623-624 (2021);
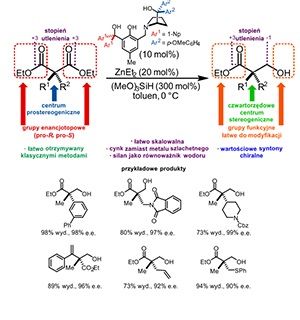
Ogólna metoda zapewniająca łatwy dostęp do związków bioaktywnych z czwartorzędowym centrum stereogenicznym jest Świętym Graalem syntezy stereoselektywnej. Połączenie klasycznych transformacji organicznych z odkryciem nowego układu katalitycznego na bazie cynku do desymetryzacji prochiralnych α,α-dipodstawionych estrów malonowych stanowi ważny krok do osiągnięcia tego celu.
Powszechnie uważa się, że Natura stanowi niewyczerpane źródło związków chiralnych, ale zazwyczaj jednego z enancjomerów, co pozostawia kwestię pozyskiwania przeciwnego enancjomeru nierozwiązaną. Dlatego podejmuje się w ostatnich latach działania, w których metody syntezy bazujące na materiałach pochodzenia naturalnego są zastępowane nowymi wykorzystującymi albo stechiometryczne albo katalityczne ilości “chiralnego induktora” (chiralnego pomocnika lub katalizatora). To ostatnie stanowi obecnie dominujące podejście w chemii. "Właściwy" katalizator stosowany w syntezie asymetrycznej powinien być jednocześnie wysoce aktywny, łatwo dostępny i tani. Jak można się domyślić jednoczesne spełnienie tych warunków jest niemożliwe.
Alternatywna do rozdziału racematów i tworzenia nowych elementów chiralności desymetryzacja, stanowi dogodne rozwiązanie problem pozyskiwania związków optycznie czynnych w formie pojedynczych enancjomerów. W czasie reakcji desymetryzacji element(y) symetrii jest tracony, co oznacza, że cząsteczka prochiralna jest zamieniana w chiralną. W najprostszym przypadku, z dwóch tych samych grup obecnych w cząsteczce, najczęściej związanych z tym samym atomem, jedna ulega przemianie chemicznej w inną grupę. Ta metoda jest szczególnie użyteczna w przypadku, gdy celem syntetycznym jest związek z czwartorzędowym atomem węgla. Z drugiej strony, ograniczona liczba prochiralnych substratów, trudności z kontrolą stereochemii i stopnia przereagowania substratu, limitują praktyczne zastosowanie tej metody pozyskiwania substancji optycznie czynnych.
Nowo opracowana metoda desymetryzacji podwójnie podstawionych malonianów pozwala na otrzymywanie chiralnych syntonów z czwartorzędowym centrum stereogenicznym, czyli związków o dużym znaczeniu syntetycznym. Podstawą metody jest katalizowane cynkiem asymetryczne hydrosililowanie (AHS) jednej z grup estrowych obecnych w cząsteczce. W tej reakcji wodorosilan jest zamiennikiem gazowego wodoru a hydrosililowanie może być rozpatrywane jako addycja sililowanego nukleofila (wodorku) do grupy karbonylowej.